Photocatalyse : Différence entre versions
(→Exemples d'applications) |
(→Caractèristiques techniques) |
||
| Ligne 31 : | Ligne 31 : | ||
de la quantité de TiO2 en surface et de la durée du contact entre le TiO2 et les matières présentes dans l’air. | de la quantité de TiO2 en surface et de la durée du contact entre le TiO2 et les matières présentes dans l’air. | ||
| − | [[Image:Photocatalyse|thumb|500px|légende]] | + | [[Image:Photocatalyse.jpg|thumb|500px|légende]] |
==Exemples d'applications== | ==Exemples d'applications== | ||
Version du 16 mai 2008 à 15:09
Sommaire
Définitions
Revêtement réalisant la photocalyse lui conférant des propriétés auto-nettoyantes et dépolluantes
La photocatalyse est le phénomène naturel dans lequel une substance, appelée
photocatalyseur, accélère la vitesse d’une réaction chimique sous l’action de
la lumière (naturelle ou artificielle). Lors de cette réaction, le catalyseur
n’est ni consommé ni altéré. Cette réaction présente beaucoup de similitude avec
la synthèse chlorophyllienne.
En utilisant l’énergie lumineuse, l’eau et l’oxygène de l’air, les photocatalyseurs
engendrent la formation de molécules très réactives (appelées radicaux libres), capables
de décomposer certaines substances, organiques et inorganiques, présentes dans l’atmosphère
et parfois nocives, en composés totalement inoffensifs par oxydo-réduction.
Caractèristiques techniques
Le catalyseur le plus utilisé est le dioxyde de titane TiO2) car thermodynamiquement stable, non toxique et économique.
En exposant ce catalyseur et semi-conducteur à la lumière (du soleil ou de l'éclairage artificiel) comportant un composant UV
longueur d’onde < 387 nm), une activation a lieu. Cette énergie peut à son tour enclencher d’autres processus, tels que des
réactions redox et des transformations moléculaires, avec des matières présentes dans l’atmosphère environnante.
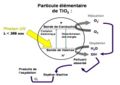
La réaction photocatalytique a lieu à la surface du matériau et se déroule en plusieurs phases. Par l’action de la lumière du soleil
sur le semi-conducteur (TiO2) se forment des paires électron-trou. Ces électrons-trous peuvent ou bien se recombiner, ou bien rester
séparés par l’adsorption d’autres matières à la surface (polluants). Des réactions d’oxydation et de réduction peuvent ensuite se produire
entre les électrons capturés et les polluants adsorbés. Les produits formés peuvent être évacués par les eaux de pluie et/ou passer dans l’atmosphère.
La surface est ainsi efficacement nettoyée, on parle de surfaces autonettoyantes. Le TiO2 même ne participe pas à la réaction et ne se décompose donc pas.
Tant qu’il est en contact avec la lumière et les polluants, il reste stable et efficace. La photocatalyse hétérogène utilisant du TiO2 comme photocatalyseur
minéralise un très large éventail de composés organiques (alcanes, alcènes, alcools, pesticides, etc.). Il est également possible de réduire ou d’oxyder
plusieurs autres produits (NOx, bactéries, virus, pollens, acariens, etc.). La vitesse à laquelle ces réactions ont lieu dépend de l’intensité de la lumière,
de la quantité de TiO2 en surface et de la durée du contact entre le TiO2 et les matières présentes dans l’air.