Cellules graetzel : Différence entre versions
| Ligne 1 : | Ligne 1 : | ||
| − | + | ='''INTRODUCTION'''= | |
La découverte de l'effet photovoltaïque remonte à l'année 1839 quand le physicien français Edmond Becquerel observa le changement de la tension d'une électrode en platine sous l'effet de l'illumination avec la lumière, Einstein cn expliqua le mécanisme en 1912, mais cela resta une curiosité scientifique de laboratoire. La génération d' une petite quantité d'électricité par l'illumination de certains solides tels que le sélénium fut étudiée par Heinrich Hertz dès les années 1870. Avec des rendements de l'ordre de 1%, le sélénium fut rapidement adopté par des photographes comme luxmètre. | La découverte de l'effet photovoltaïque remonte à l'année 1839 quand le physicien français Edmond Becquerel observa le changement de la tension d'une électrode en platine sous l'effet de l'illumination avec la lumière, Einstein cn expliqua le mécanisme en 1912, mais cela resta une curiosité scientifique de laboratoire. La génération d' une petite quantité d'électricité par l'illumination de certains solides tels que le sélénium fut étudiée par Heinrich Hertz dès les années 1870. Avec des rendements de l'ordre de 1%, le sélénium fut rapidement adopté par des photographes comme luxmètre. | ||
| Ligne 25 : | Ligne 25 : | ||
| − | {{Image|Coupe_de_cellule.jpg|schéma de coupe de la cellule.|style=;}} | + | {{Image|Coupe_de_cellule.jpg|schéma de coupe de la cellule.|LargeurImage|l=900|h=525|style=;}} |
Version du 7 mai 2008 à 16:11
INTRODUCTION
La découverte de l'effet photovoltaïque remonte à l'année 1839 quand le physicien français Edmond Becquerel observa le changement de la tension d'une électrode en platine sous l'effet de l'illumination avec la lumière, Einstein cn expliqua le mécanisme en 1912, mais cela resta une curiosité scientifique de laboratoire. La génération d' une petite quantité d'électricité par l'illumination de certains solides tels que le sélénium fut étudiée par Heinrich Hertz dès les années 1870. Avec des rendements de l'ordre de 1%, le sélénium fut rapidement adopté par des photographes comme luxmètre. De rapides progrès furent obtenus dès les années 1950 par les équipes des Bell Laboratories aux Etats-Unis qui fabriquèrent la première cellule au silicium cristallin d'un rendement de 4% à partir du procédé de tirage de Czochralski. Ce furent en fait les programmes spatiaux qui donnèrent à cette technologie ces premières applications pratiques. En 1958 le satellite artificiel américain Vanguard emporta un petit générateur solaire pour alimenter sa radio. Jusqu'au milieu des années 70, les photopiles étaient vraiment trop chères pour être économiquement utilisées sur terre. Ce n'est que depuis le deuxième choc pétrolier qu'un intérêt véritable s'est rapidement propagé à travers le monde pour les applications énergétiques terrestres des photopiles.
Présentation du problème
Les piles solaires existantes sont à base de silicium, impliquant un coût de fabrication nécessairement élevé.
En effet, les piles solaires traditionnelles convertissent la lumière en électricité en exploitant l'effet photovoltaïque qui apparaît à la jonction de semi-conducteurs.
Ce sont donc des dispositifs proches des transistors ou des circuits intégrés.
Le semi-conducteur remplit simultanément les fonctions d'absorption de la lumière et de séparation des charges électriques résultantes. Pour que ces deux processus soient efficaces, les cellules doivent être constituées de matériaux de haute pureté.
Leur fabrication est par conséquent onéreuse, ce qui limite leur emploi pour la production d'électricité à grande échelle.
Les piles que nous allons étudier fonctionnent selon un autre principe, qui différencie les fonctions d'absorption de la lumière et de séparation des charges électriques.
Elles offrent, par leur simplicité de fabrication, l'espoir d'une réduction significative du prix de l'électricité solaire.
- Principe de fonctionnement
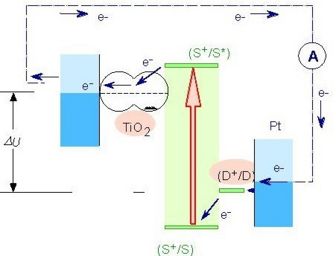
Comme dans le cas de la photosynthèse naturelle, l'absorption d'énergie solaire met en route une pompe à électrons mue par l'énergie lumineuse absorbée, dont le principe est illustré dans la ci-dessous.
Le sensibilisateur (S) est greffé à la surface d’un oxyde semi-conducteur sous la forme d'une couche monomoléculaire. Il absorbe les rayons solaires incidents qui le promeuvent dans un état électroniquement excité S*, d'où il est à même d'injecter un électron dans la bande de conduction du dioxyde de titane.
Les électrons ainsi injectés traversent la couche et sont ensuite recueillis par un collecteur de courant qui permet de les diriger vers un circuit externe où leur passage produit de l'énergie électrique.
Le retour de l'électron dans la bande de conduction sur le colorant oxydé S+ est beaucoup plus lent que la réduction de S+ par le médiateur (D) en solution. De ce fait la séparation de charge est efficace.
Le médiateur oxydé (D+) est réduit à la contre-électrode.
La tension maximale débitée correspond à la différence entre le potentiel d'oxydoréduction du médiateur et le niveau de Fermi du semi-conducteur.
La charge positive est transférée du colorant (S+) à un médiateur (iodure) présent dans la solution qui baigne dans la cellule (interception). Ce médiateur, alors oxydé en tri-iodure, diffusé à travers la solution. Ainsi, le cycle des réactions redox est bouclé par transformation de l'énergie solaire absorbée en un courant électrique, sans changement de la composition de quelque partie du système que ce soit.
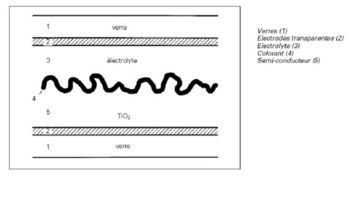
Une cellule où la génération des porteurs et leur séparation sont assurées par deux matériaux différents, le générateur de charge est un colorant absorbant qui est déposé sur un semi-conducteur à gap optimal ou proche de l’optimal. La structure présentée utilise les composants suivants :
- sur un substrat de verre, on dépose tout d’abord une couche métallique transparente, l’électrode négative.
- ensuite un semi-conducteur, le TiO2 (dioxyde de titane) qui établit un bon contact ohmique avec l’électrode.
- sur le TiO2 on ajoute un colorant à molécules complexes (l’absorbeur) dont la structure est proche de la chlorophylle.